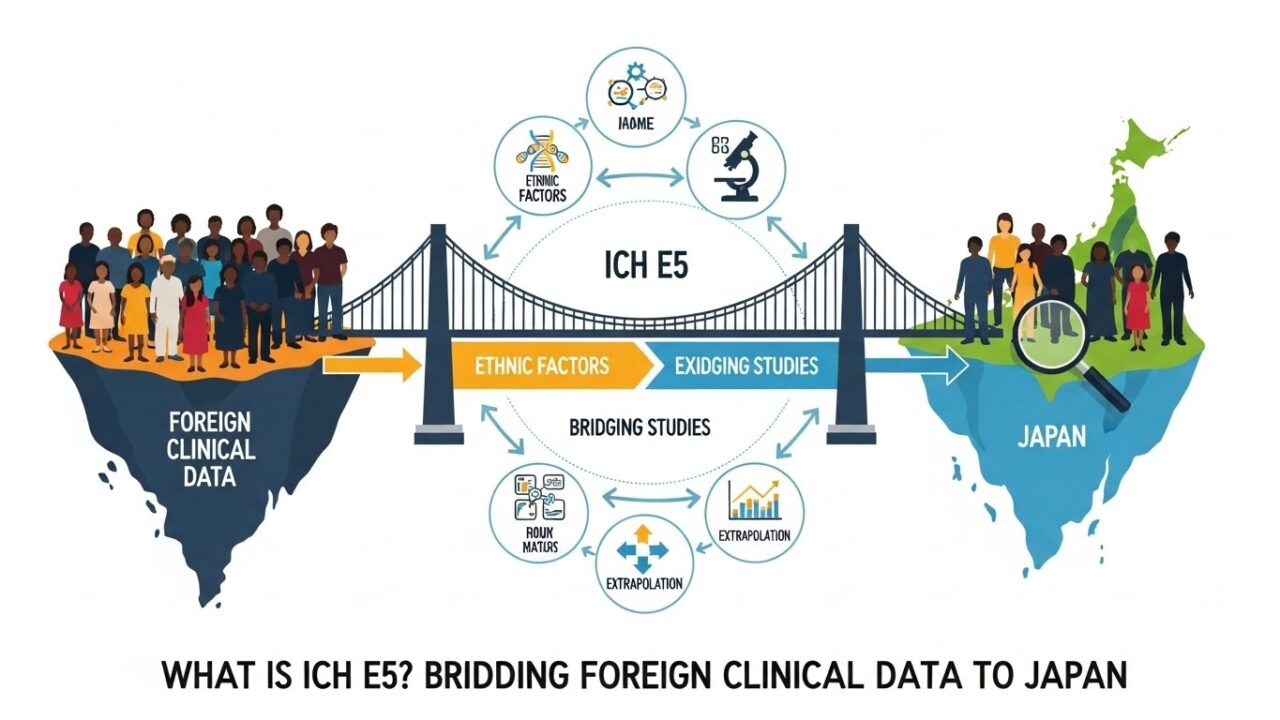
【完全解説】ICH E5とは何か?外国臨床データを日本で活用するための“ブリッジング”の考え方― 民族的要因・ブリッジング試験・外挿可能性を徹底解説 ―
記事の目次
Toggleはじめに
医薬品開発はグローバル化が進み、欧米で得られた臨床データを日本でも活用することが当たり前になってきました。しかし、単純に「外国で効いたから日本でも効くはず」とはいきません。その理由が民族的要因(Ethnic Factors) です。
こうした課題に対し、ICH(国際医薬品規制調和会議)がまとめたのが ICH E5 指針です。
本記事ではICH E5 の本質を図解つきでわかりやすく解説します。
ICH E5とは何か?
ICH E5 は、外国臨床データを新しい地域(日本など)で承認申請に使う際に、
民族的要因が医薬品の効果に与える影響をどう評価するかを示した国際ガイドラインです。
- 外国臨床データを新地域に外挿できる条件を示す
- 臨床試験の国際的な重複を減らす
- 必要な場合のブリッジング試験の考え方を示す
- 民族的要因が医薬品の効果に与える影響を整理する
① 外国データが規制要件を満たすか?
② 日本人に外挿できるか?
└→ 必要ならブリッジング試験を実施
③ 外挿可能なら外国データを承認資料として活用
なぜ「民族的要因」が重要なのか?
ICH E5 では民族的要因を 内因性 と 外因性 に分類しています。
内因性民族的要因(Intrinsic):遺伝・生理的特徴など、個人の体質に関わる要因。
- 遺伝多型(CYP など)
- 年齢・性別
- 体格(身長・体重)
- 臓器機能(肝・腎)
- 受容体の感受性
外因性民族的要因(Extrinsic):文化・環境・医療習慣など、生活環境に関わる要因。
- 食事(脂質量、塩分、発酵食品など)
- 医療習慣(併用薬、治療方針)
- 診断基準
- 服薬遵守
- 気候・日照
- 社会経済状況
外国臨床データを日本で使うための2つのステップ
ICH E5 では、外国データを日本で使うために 2段階の評価 を行います。
ステップ1:規制要件を満たしているか?
外国データが日本の規制要件(GCP、信頼性基準、適切な対照群など)を満たしているかを確認。
ステップ2:日本人に外挿可能か?
民族的要因の違いにより、外国データが日本人に当てはまるかを評価。
外挿が難しい場合は ブリッジング試験 が必要になります。
ブリッジング試験とは何か?
ブリッジング試験とは、外国臨床データを日本人に外挿できることを示すための補完的試験のことです。
- 日本人の薬物動態(PK)データ
- 必要に応じて薬力学(PD)・用量反応データ
- 必要な場合のブリッジング試験(有効性・安全性)
- 民族的要因の影響が小さい薬物
- 類似薬の日本での経験が豊富
- 外因性要因(医療習慣など)が類似している
- PK/PD に民族差がある
- 医療習慣が大きく異なる
- 類似薬の日本での経験が少ない
- 外国データの比較試験の受入れ経験が少ない
有効性に関するブリッジング試験
ICH E5 では、有効性のブリッジング試験を以下のように整理しています。
① ブリッジング試験が不要な場合
- 民族差が小さい薬物
- 類似薬の日本での経験が豊富
- 外因性要因が類似している
② 薬理学的エンドポイントを用いた試験
- PD 指標(血圧、コレステロールなど)で比較
- PK/PD の整合性が取れれば外挿可能
③ 比較臨床試験が必要な場合
- 用量設定の根拠が弱い
- 医療習慣が異なる
- 類似薬の日本での経験が乏しい
- 外国の比較試験の受入れ経験が少ない
安全性に関するブリッジング試験
安全性は有効性よりも民族差が出にくいことが多いですが、以下の場合は追加データが必要です。
✅ 安全性ブリッジングが必要なケース
- 重篤な有害事象が外国で報告されている
- 日本人で発生率が高くなる可能性がある
- 有効性ブリッジング試験の規模が小さい
✅ 1%の有害事象を検出するには300例必要
ICH E5 では、一般的に発生率1%の有害事象を検出するには300例必要とされています。
ただし、これは外国データと合わせて評価すればよく、日本だけで300例を集める必要はありません。
Q&A 文書から読み取れる実務的ポイント
添付の Q&A 文書は、ICH E5 の実務運用を理解するうえで非常に重要です。
特に以下の点が実務でよく問題になります。
① 外国データの「全部」を提出する必要はあるか?
→ 主要試験の要約とリストは必須
(透明性の確保のため)
② 外国の対照薬が日本で未承認でも使えるか?
→ 科学的に妥当なら利用可能
③ 日本人と外国人で PK が違っても外挿できるか?
→ 用量調整で整合性が取れれば外挿可能
④ 多国籍試験で民族差を解析すればブリッジング不要か?
→ 十分な症例数があれば可能
⑤ 希少疾病用医薬品はどう扱うか?
→ ブリッジング試験を一律に求めない
(市販後調査で補完)
まとめ
ICH E5 指針は、外国で得られた臨床データを日本を含む新地域で承認審査に活用するための枠組みを示したガイドラインです。民族的要因(遺伝・生理・医療習慣など)が医薬品の効果に与える影響を科学的に評価し、外挿可能性を判断します。必要に応じてブリッジング試験を行い、追加データを最小限にしつつ、国際的な重複試験を減らし、医薬品を迅速に患者へ届けることを目的としています。