ICH E4ガイドライン解説:用量-反応試験の意義と実践

記事の目次
Toggleはじめに
1994年に採択されたICH E4「用量-反応情報を用いた医薬品承認の支援」は、医薬品開発において欠かせない基盤的ガイドラインです。薬の効果と副作用は「どのくらいの量を投与するか」に大きく依存します。過去には過剰投与による副作用が社会問題となった事例もあり、最小有効量から最大有用量までの範囲を科学的に把握することが重要視されるようになりました。
本記事では、ICH E4について用量-反応試験の目的・設計・規制的意義をわかりやすく整理し、図解を交えて解説します。研究者や製薬業界の方はもちろん、統計学や臨床試験に関心のある方にも理解しやすい内容を目指します。
用量-反応情報の目的
安全で効果的な投与のために
- 用量-反応曲線は、薬の投与量と効果(有効性・副作用)の関係を示すもの。
- 適切な開始用量、漸増方法、最大推奨量を決定する基盤となる。
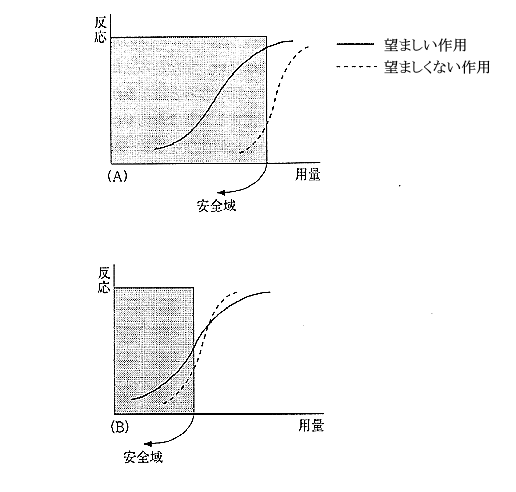
推奨用量は望ましい作用と望ましくない作用の用量ー反応関係を推定した上で、治療上の必要性を考慮し、両者のバランスを考えて許容できる用量範囲を選びます。
規制的意義
- 共通データベースに基づき、各国規制当局が承認判断を行える → グローバル開発の効率化。
- ラベリング(添付文書)の投与方法記載に直結。
用量-反応情報の活用場面
初期投与量の選択
- 効果と副作用の分離度が大きい薬 → 高用量から開始も可能。
- 分離度が小さい薬 → 低用量から開始し、忍容性を確認しながら漸増。
個別患者への調整
- 集団平均曲線と個別曲線は異なる。
- 年齢・性別・体重・腎機能・薬物相互作用などの要因を考慮。
濃度-反応情報の役割
濃度情報は最終的に用量情報へ翻訳され、臨床現場での投与設計に活用される。
- 濃度-反応関係を把握することで、新製剤(徐放剤など)の評価や薬物相互作用の影響を予測可能。
- 血中濃度モニタリングが必須の薬(例:抗てんかん薬、免疫抑制薬)では不可欠。
用量-反応試験デザインの課題
Titration(漸増)デザインの問題点
- 時間経過による自然改善と用量増加効果の区別が困難。
- 高用量が「推奨量」とされやすく、副作用リスク増大。
- 例:AZT(ジドブジン)初期承認時は高用量で開始 → 後に低用量でも有効かつ忍容性良好と判明。
時間との相互作用
- 朝夕で効果が異なる場合や、累積投与による耐性・寛容化。
- 半減期と投与間隔の関係。
試験デザインの種類
平行群固定用量試験(Parallel dose-response)
- 最も標準的で信頼性が高い。
- プラセボ群を含めることで「有効性の絶対値」を確認可能。
- 複数群にランダム化し、固定用量で比較。
クロスオーバー試験(Cross-over)
- 同一患者が複数用量を順次体験。
- 個別曲線の推定が可能。
- ただし脱落やキャリーオーバー効果に注意。
強制漸増試験(Forced titration)
- 全員が一定ステップで用量を増加。
- プラセボ群を併用すれば有効性確認可能。
- 時間依存効果との混同が課題。
任意漸増試験(Optional titration)
- 患者を効果・副作用の到達点まで漸増。
- 粗解析では「逆U字型」誤解が生じやすい。
- 高度な統計モデルで補正すれば有効な情報を得られる。
規制科学的視点
- FDA・EMA・PMDAはいずれも、用量-反応情報を承認審査の重要要素と位置づけ。
- 不完全なデータでも「生命を救う薬」であれば承認 → ただし市販後試験で補完。
- データベース全体を解析し、体重・腎機能などの共変量との関連を探索することが推奨。
まとめ
ICH E4ガイドラインは、医薬品開発において「用量-反応情報」を体系的に収集・活用することの重要性を示しています。薬の効果と副作用は投与量に依存し、最小有効量から最大有用量までの範囲を科学的に把握することで、安全かつ効果的な治療が可能になります。
ガイドラインは、開始用量の選択、個別患者への調整、濃度-反応情報の活用、試験デザインの工夫などを通じて、合理的な投与設計を行うことを推奨しています。特に平行群固定用量試験が標準的ですが、疾患特性に応じてクロスオーバー試験や漸増試験も活用されます。
また、重篤疾患では倫理的制約から低用量試験が困難な場合もありますが、濃度データや市販後試験を通じて最適投与範囲を補完する柔軟性が認められています。規制当局は不完全なデータでも生命を救う薬であれば承認する一方、市販後に追加情報を求める姿勢を示しています。
要するに、ICH E4は「用量-反応情報を臨床試験の初期段階から組み込み、患者個別性を考慮しつつ、科学的根拠に基づいた最適投与を確立する」ことを目指すガイドラインです。これにより、研究者は効率的な試験設計を行え、患者にはより安全で効果的な治療が提供されます。
参考資料
新医薬品の承認に必要な用量-反応関係の検討のための指針(1994年7月25日)