フェーズ3臨床試験の流れと統計解析担当者の役割― 被験者組み入れから DBL までを徹底解説 ―
記事の目次
Toggleはじめに
フェーズ3(Ph3)臨床試験は、医薬品承認申請に直結する最重要ステージです。
この段階では、大規模な患者集団を対象に、有効性と安全性を最終的に検証することが目的となります。
そのため、試験デザイン、データ品質、解析計画、TFL(Tables, Figures, Listings)の作成など、統計解析担当者の役割は極めて重要です。
この記事では、被験者が組み入れられてから DBL に至るまでの流れを、統計解析担当者の視点から丁寧に解説します。
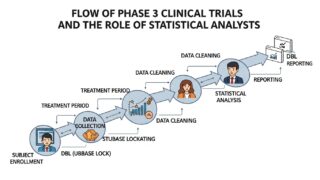
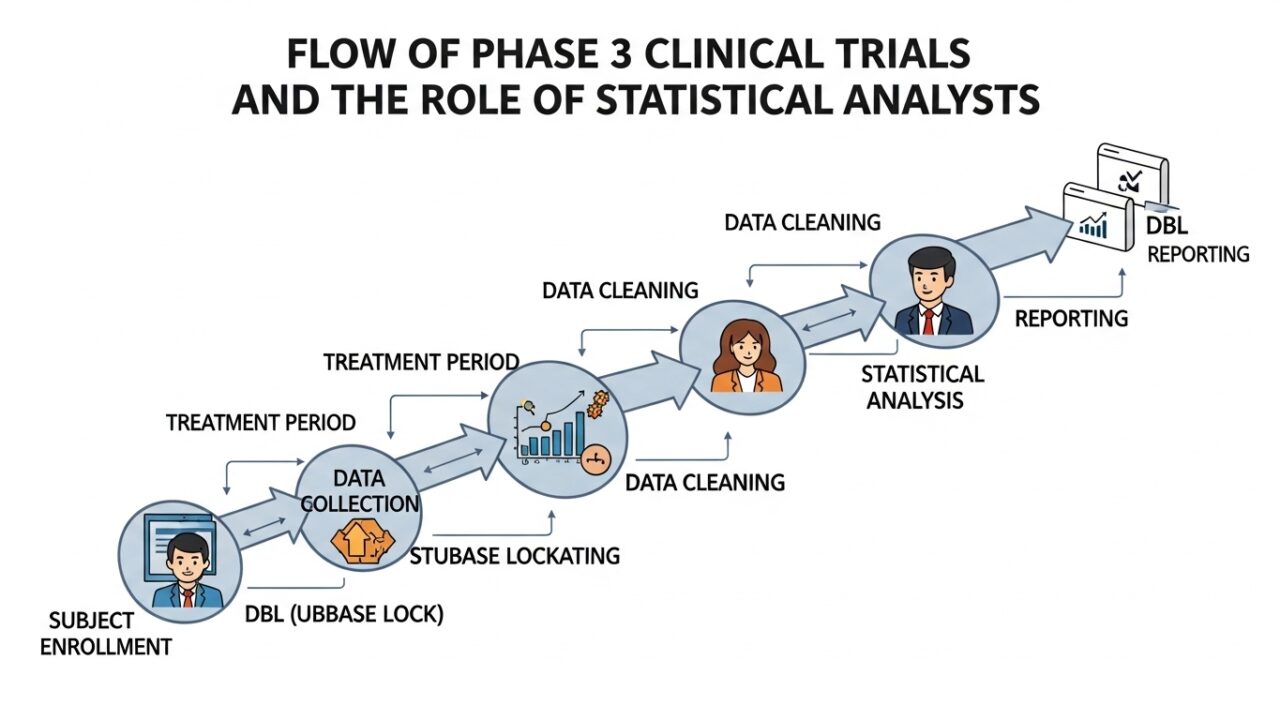
Ph3 試験の全体像
まずは、フェーズ3試験の全体フローを俯瞰してみましょう。
[試験開始前]
├─ プロトコル作成
├─ 統計解析計画(SAP)作成
├─ EDC構築 / CRF設計
└─ プログラム雛形作成(TFL Shell)
[被験者組み入れ後]
├─ 登録・割付
├─ データ収集(EDC)
├─ 中間データレビュー
├─ 品質管理(DM・統計)
└─ 解析プログラム作成
[試験終了後]
├─ データクリーニング完了
├─ DBL(Data Base Lock)
├─ 主要解析実施
└─ CSR(Clinical Study Report)作成
統計解析担当者は、試験開始前から DBL 後の CSR 完成まで、ほぼ全工程に関与します。
被験者組み入れ後の流れ(統計解析担当者の視点)
ここからは、被験者が組み入れられた後の実務フローにフォーカスします。
被験者組み入れ(Enrollment)
被験者が組み入れられると、EDC(Electronic Data Capture)にデータが入力され始めます。
- EDC 仕様の最終確認
- CRF(症例報告書)項目と解析変数の整合性チェック
- ランダム化リストの管理(統計チームが担当することが多い)
- データフローの確認(EDC → SDTM → ADaM → TFL)
データ収集とクリーニング(Data Management と連携)
被験者の来院ごとにデータが入力され、DM(データマネジメント)がクリーニングを進めます。
● SDTM/ADaM 仕様の作成・レビュー
- SDTM(標準化データ)
- ADaM(解析用データセット)
特に ADaM は統計解析担当者の責任範囲であり、解析に必要な変数の定義を明確にします。
● クエリ発行のサポート
DM が主体ですが、統計側からも以下のような指摘を行います。
- 異常値の検出
- 来院スケジュールの逸脱
- 主要評価項目の欠測の確認
● データレビュー会議(Data Review Meeting)
DM・統計・メディカルが定期的に集まり、データ品質を確認します。
中間解析・データモニタリング(必要に応じて)
Ph3 試験では、以下のような中間解析が行われることがあります。
- 安全性モニタリング(DSMB)
- 有効性の中間解析(早期終了の判断など)
- 中間解析用の SAP(Statistical Analysis Plan)補足文書作成
- 中間解析用の ADaM/TFL 作成
- ブラインド保持のための 独立統計家との連携
SAP(統計解析計画書)の作成
SAP は、統計解析担当者の最重要ドキュメントです。
- 解析集団(FAS, PPS, Safety Set)
- 主要/副次評価項目の解析方法
- 欠測値処理方法
- 感度解析の計画
- サブグループ解析
- 多重性調整
- TFL の仕様(Shell)
SAP はプロトコルの統計章をより詳細化したもので、DBL 後の解析は SAP に完全準拠して実施されます。
TFL(Tables, Figures, Listings)作成
TFL は、最終的に CSR に掲載される解析結果です。
- TFL Shell(雛形)の作成
- 解析プログラム(SAS/R)の作成
- QC(Quality Control)プログラムの作成
- 図表のレイアウト調整
TFL Shell は SAP と密接にリンクしており、解析の再現性と透明性を担保する重要な文書です。
データクリーニング完了〜DBL まで
試験終了後、DM がデータクリーニングを完了させ、統計解析担当者は以下を実施します。
Pre-DLB(DBL 前作業)
- 最終 SDTM/ADaM の作成
- TFL プログラムの最終 QC
- データ不整合の最終チェック
- ブラインド解除の準備
DBL(Data Base Lock)
DBL は、データが完全に確定し、以降は一切変更できない状態にすることを意味します。DBL の瞬間から、統計解析担当者は 主要解析(Primary Analysis) に着手します。
DBL 後の解析と CSR 作成
DBL 後は、統計解析担当者の最も忙しい期間です。
● 主要解析の実施
- 主要評価項目の解析
- 副次評価項目の解析
- 感度解析
- サブグループ解析
● TFL の最終版作成
- CSR に掲載する図表を最終化
- QC を実施し、解析の再現性を保証
● CSR(Clinical Study Report)への反映
- メディカルライターと連携し、解析結果を文章化
- 統計解析担当者は CSR の統計章(Section 14)を担当
まとめ
フェーズ3臨床試験では、被験者が組み入れられてから DBL(Data Base Lock)に至るまで、膨大なデータが収集され、品質管理が行われ、最終的な解析へと進んでいきます。その過程で、統計解析担当者は試験の根幹を支える重要な役割を担います。
まず、被験者の組み入れ後は、EDC を通じてデータが入力され始め、統計解析担当者は CRF 項目と解析計画の整合性を確認しつつ、SDTM/ADaM 仕様の策定やデータレビューに関与します。データマネジメントと連携しながら、異常値や欠測の確認、クエリ対応、データレビュー会議などを通じて、解析に耐えうるデータ品質を確保していきます。
試験の進行に応じて、必要に応じて中間解析や安全性モニタリングが行われ、その際には SAP の補足文書作成や中間解析用データセットの作成など、統計解析担当者の専門性が求められます。並行して、最終解析に向けた SAP(統計解析計画書)の詳細化、TFL Shell の作成、解析プログラムの準備が進められます。
試験終了後は、データクリーニングの最終段階に入り、統計チームは ADaM の最終化、TFL プログラムの QC、データ不整合の最終チェックなど、DBL に向けた重要な作業を行います。DBL が完了すると、データは固定され、主要解析が正式に開始されます。統計解析担当者は、主要評価項目・副次評価項目の解析、感度解析、サブグループ解析などを実施し、TFL を最終化します。
最終的には、解析結果を CSR(Clinical Study Report)に反映し、統計章の執筆やメディカルライターとの連携を通じて、承認申請に必要な科学的根拠を整えていきます。
このように、統計解析担当者は、試験デザインからデータ品質管理、解析、報告書作成まで、臨床試験の全工程に深く関与する存在です。フェーズ3試験は規模が大きく複雑ですが、統計解析担当者の計画性と技術力が、信頼性の高いエビデンスを生み出す基盤となっています。